Tofacitinib citrate là một loại thuốc kê đơn (tên thương mại Xeljanz) ban đầu được Pfizer phát triển cho một nhóm thuốc ức chế Janus kinase (JAK) đường uống. Nó có thể ức chế chọn lọc JAK kinase, chặn các con đường JAK/STAT và do đó ức chế sự truyền tín hiệu tế bào cũng như sự biểu hiện và kích hoạt gen liên quan, được sử dụng để điều trị viêm khớp dạng thấp, viêm khớp vẩy nến, viêm loét đại tràng và các bệnh miễn dịch khác.
Thuốc bao gồm ba dạng bào chế: viên nén, viên nén giải phóng kéo dài và dung dịch uống. Máy tính bảng của nó lần đầu tiên được FDA phê duyệt vào năm 2012 và dạng bào chế giải phóng kéo dài đã được FDA phê duyệt vào tháng 2 năm 2016. Đây là dạng thuốc đầu tiên điều trị bệnh khớp dạng thấp. Yan là chất ức chế JAK uống mỗi ngày một lần. Vào tháng 12 năm 2019, một chỉ định mới về thuốc giải phóng kéo dài đã được phê duyệt một lần nữa cho bệnh viêm loét đại tràng hoạt động từ trung bình đến nặng (UC). Ngoài ra, các thử nghiệm lâm sàng giai đoạn 3 hiện tại đối với bệnh vẩy nến mảng bám đã được hoàn thành và sáu thử nghiệm lâm sàng giai đoạn 3 khác đang được tiến hành, liên quan đến viêm khớp vẩy nến đang hoạt động, viêm khớp vô căn ở trẻ vị thành niên, v.v. Ưu điểm của viên nén giải phóng kéo dài là tác dụng kéo dài, chỉ cần uống 1 lần/ngày có lợi cho việc quản lý và kiểm soát bệnh tật của người bệnh.
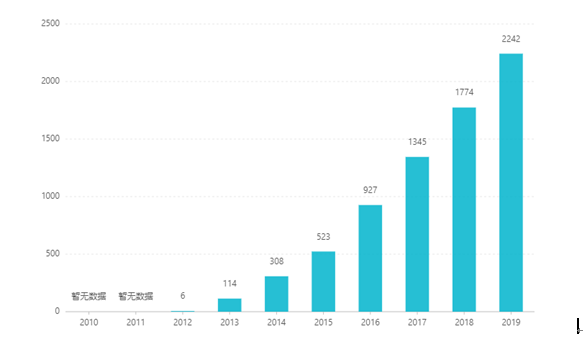
Kể từ khi niêm yết, doanh số bán hàng của nó đã tăng lên hàng năm, đạt 2,242 tỷ USD vào năm 2019. Tại Trung Quốc, dạng bào chế dạng viên nén đã được phê duyệt để tiếp thị vào tháng 3 năm 2017 và được đưa vào danh mục bảo hiểm y tế loại B thông qua đàm phán vào năm 2019. Chiến thắng mới nhất giá thầu là 26,79 RMB. Tuy nhiên, do rào cản kỹ thuật cao của chế phẩm giải phóng kéo dài nên dạng bào chế này vẫn chưa được bán trên thị trường Trung Quốc.
JAK kinase đóng vai trò quan trọng trong tình trạng viêm và các chất ức chế của nó đã được chứng minh là có tác dụng điều trị một số bệnh viêm và tự miễn dịch. Tính đến nay, 7 thuốc ức chế JAK đã được phê duyệt trên toàn cầu gồm Delgocitinib của Leo Pharma, Fedratinib của Celgene, upatinib của AbbVie, Pefitinib của Astellas, Baritinib của Eli Lilly và Rocotinib của Novartis. Tuy nhiên, chỉ có tofacitinib, baritinib và rocotinib được chấp thuận ở Trung Quốc trong số các loại thuốc nói trên. Chúng tôi mong muốn “Viên nén phóng thích bền vững Tofatib Citrate” của Qilu được phê duyệt càng sớm càng tốt và mang lại lợi ích cho nhiều bệnh nhân hơn.
Tại Trung Quốc, nghiên cứu ban đầu về tofacitib citrate đã được NMPA phê duyệt vào tháng 3 năm 2017 để điều trị cho bệnh nhân RA trưởng thành không đủ hiệu quả hoặc không dung nạp với methotrexate, dưới tên thương mại là Shangjie. Theo dữ liệu từ Meinenet, doanh số bán thuốc tofacitib citrate tại các cơ sở y tế công của Trung Quốc năm 2018 là 8,34 triệu nhân dân tệ, thấp hơn nhiều so với doanh số toàn cầu. Một phần lớn lý do là giá cả. Được biết, giá bán lẻ ban đầu của Shangjie là 2085 nhân dân tệ (5mg * 28 viên), chi phí hàng tháng là 4170 nhân dân tệ, đây không phải là gánh nặng nhỏ đối với các gia đình bình thường.
Tuy nhiên, điều đáng mừng là tofacitib đã được Cơ quan Quản lý Bảo hiểm Y tế Quốc gia đưa vào “Danh sách thuốc bảo hiểm y tế cơ bản quốc gia, bảo hiểm thương tật lao động và thai sản” năm 2019 sau khi đàm phán vào tháng 11 năm 2019. Có thông tin cho rằng phí hàng tháng sẽ giảm xuống dưới 2.000 nhân dân tệ sau khi thương lượng việc giảm giá, điều này sẽ cải thiện đáng kể khả năng sẵn có của thuốc.
Vào tháng 8 năm 2018, Ủy ban Xem xét lại Bằng sáng chế của Văn phòng Sở hữu Trí tuệ Tiểu bang đã đưa ra quyết định xem xét số 36902 yêu cầu vô hiệu hóa và tuyên bố bằng sáng chế cốt lõi của Pfizertofatib, bằng sáng chế phức hợp, là không hợp lệ với lý do không tiết lộ đầy đủ thông số kỹ thuật. Tuy nhiên, bằng sáng chế dạng tinh thể Pfizertofatiib (ZL02823587.8, CN1325498C, ngày nộp đơn 2002.11.25) sẽ hết hạn vào năm 2022.
Cơ sở dữ liệu của Insight cho thấy, ngoài nghiên cứu ban đầu, 5 loại thuốc generic là Chia Tai Tianqing, Qilu, Kelun, Yangtze River và Nanjing Chia Tai Tianqing đã được phê duyệt để tiếp thị ở dạng viên nén tofacitinib trong nước. Tuy nhiên, đối với loại máy tính bảng giải phóng kéo dài, chỉ có nghiên cứu ban đầu Pfizer đã nộp đơn đăng ký tiếp thị vào ngày 26 tháng 5. Qilu là công ty trong nước đầu tiên nộp đơn đăng ký tiếp thị cho công thức này. Ngoài ra, CSPC Ouyi đang trong giai đoạn thử nghiệm BE.
Nhà máy Dược phẩm Thường Châu (CPF) là nhà sản xuất dược phẩm hàng đầu về API, công thức thành phẩm tại Trung Quốc, có trụ sở tại Thường Châu, tỉnh Giang Tô. CPF được thành lập vào năm 1949. Chúng tôi đã cống hiến cho Tofacitinib Citrate từ năm 2013 và đã gửi DMF. Chúng tôi đã đăng ký ở nhiều quốc gia và có thể hỗ trợ bạn những tài liệu hỗ trợ tốt nhất về Tofacitinib Citrate.
Thời gian đăng: 23-07-2021